بدن انسان برای عملکرد صحیح سلول ها به دستورالعمل های ژنتیکی دقیق متکی است. سرطان زمانی رخ می دهد که این دستورالعمل ها مختل شوند. با تجمع تدریجی خطاهای ژنتیکی، سلول ها محدودیت های رشد طبیعی خود را از دست می دهند و خارج از کنترل تکثیر می شوند. ناهنجاری های کروموزومی، از جمله تغییرات عددی و ساختاری در کروموزوم ها، اغلب جزو اولین تغییراتی هستند که یک سلول سالم را به سمت سرطانی شدن سوق می دهند.
اکنون، محققان گروه کوربل در EMBL هایدلبرگ ابزار هوش مصنوعی جدیدی را توسعه دادهاند که به دانشمندان اجازه میدهد تا با جزئیات نحوه وقوع این ناهنجاریهای کروموزومی را بررسی کنند. یافته های این روش می تواند به روشن شدن اولین مراحلی که سلول را به سمت سرطان سوق می دهد کمک کند.
ایان کوربل، دانشمند ارشد EMBL و نویسنده اصلی این مطالعه که در مجله Nature منتشر شده است، می گوید: “ناهنجاری های کروموزومی یکی از محرک های اصلی سرطان های بسیار تهاجمی است و به شدت با مرگ بیمار، متاستاز، عود بیماری، مقاومت در برابر شیمی درمانی و شروع سریع تومور مرتبط است.” ما میخواستیم بفهمیم که چه عواملی احتمال وقوع این تغییرات را تعیین میکنند و میزان وقوع این ناهنجاریها در زمان تقسیم سلولی سالم چقدر است.»
ارتباط بین کروموزوم های غیرطبیعی و سرطان بیش از یک قرن پیش مطرح شد. تئودور بووری، دانشمند آلمانی، در مشاهدات میکروسکوپی خود پیشنهاد کرد که محتوای کروموزومی نامنظم می تواند نقش اساسی در ایجاد سرطان داشته باشد.
با این حال، شناسایی این سلول های غیر طبیعی همیشه دشوار بوده است. زیرا تنها تعداد کمی از سلول ها در هر لحظه چنین تغییراتی را نشان می دهند و بسیاری از این سلول ها یا به طور طبیعی می میرند یا در فرآیند انتخاب طبیعی حذف می شوند. به طور سنتی، محققان مجبور بودند این سلول ها را به صورت دستی و قطعه به قطعه زیر میکروسکوپ جستجو کنند و تنها تعداد کمی را می توان برای تحقیقات عمیق تر جدا کرد.
مارکو کوزنزا، محققی در گروه کوربل، پس از همکاری با گروههایی در EMBL که با چالش مشابهی روبرو بودند، به راهحلی دست یافت. او و همکارانش یک سیستم خودکار ترکیبی از میکروسکوپ خودکار، توالی یابی تک سلولی و هوش مصنوعی ساختند و نام آن را MAGIC گذاشتند. یعنی همگرایی یادگیری ماشینی با ژنومیک و تصویربرداری.
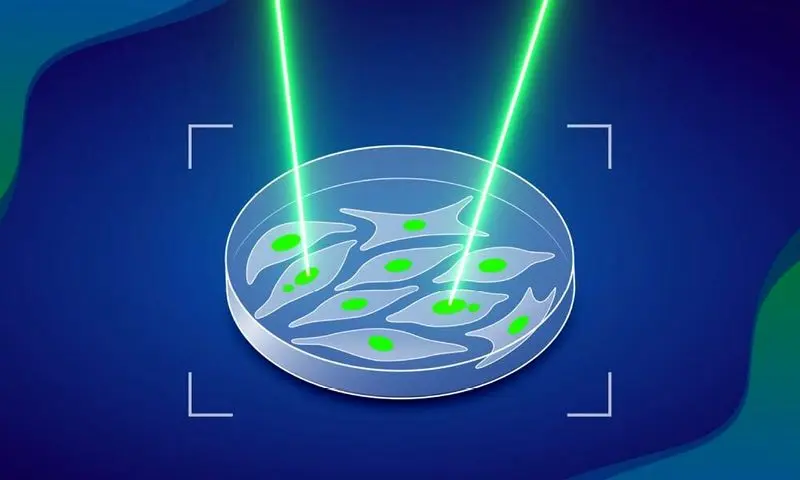
MAGIC اساساً مانند یک بازی کاملاً خودکار “برچسب لیزری” کار می کند. این سیستم سلول هایی را شناسایی می کند که دارای یک ویژگی قابل مشاهده هستند که در این مطالعه «ریزهسته» است. ریزهسته ها محفظه های کوچکی در داخل سلول هستند که بخشی از DNA جدا شده از ژنوم اصلی در آن قرار می گیرد. وجود میکرونوکلئوس نشان دهنده احتمال بالای ایجاد ناهنجاری های کروموزومی و در نتیجه احتمال سرطانی شدن سلول است.
هنگامی که سلول های دارای ریزهسته شناسایی شدند، سیستم آنها را با لیزر علامت گذاری می کند. محققان از یک رنگ تبدیل پذیر استفاده کردند. یک مولکول فلورسنت که وقتی در معرض نور قرار می گیرد، واکنش شیمیایی می دهد و رنگ نور بازتاب شده خود را تغییر می دهد.
کوزنزا میگوید: «این پروژه مجموعهای از علایق من را گرد هم آورد. از ژنومیک و تصویربرداری میکروسکوپی تا اتوماسیون رباتیک. در طول قرنطینه کرونا در سال 2020، من این فرصت را داشتم که روی یادگیری و استفاده از فناوری بینایی کامپیوتری برای تصاویر بیولوژیکی کار کنم. سپس آزمایشهایی را برای ارزیابی و توسعه این سیستم طراحی کردیم.»
در عمل، روند به شرح زیر است:
1. یک میکروسکوپ خودکار مجموعه ای از تصاویر از یک نمونه سلول را می گیرد.
2. یک الگوریتم یادگیری ماشین که بر روی نمونه های ریز هسته آموزش دیده است، تصاویر را اسکن می کند.
3. در صورت شناسایی سلول های هدف، محل آنها به میکروسکوپ گزارش می شود و سیستم به طور دائم سلول ها را با نور علامت گذاری می کند.
4. سپس این سلول های نشاندار شده را می توان با روش هایی مانند فلوسیتومتری از سایر سلول های زنده جدا کرد و تحت آنالیزهای ژنومی دقیق قرار داد.
خودکارسازی این فرآیند دستی، آهسته، مستعد خطا و زمانبر، به محققان این امکان را داده است که در مقیاسی بیسابقه کار کنند. اکنون می توان نزدیک به 100000 سلول را در کمتر از یک روز بررسی کرد. با استفاده از MAGIC، محققان ناهنجاری های کروموزومی را در سلول های کشت داده شده از سلول های طبیعی انسان بررسی کردند. نتایج نشان داد که بیش از 10 درصد از تقسیمات سلولی خود به خود به نوعی ناهنجاری کروموزومی منجر می شود. همچنین اگر ژن p53 که یکی از شناخته شده ترین ژن های سرکوب کننده تومور است جهش پیدا کند، این میزان تقریبا دو برابر می شود.
در این مطالعه عوامل دیگری نیز مورد بررسی قرار گرفت. از جمله محل و نوع شکستگی های دو رشته ای DNA روی کروموزوم ها. این پروژه حاصل همکاری گسترده بین گروه های مختلف EMBL و خارج از آن بود. از جمله مرکز میکروسکوپ نوری پیشرفته (ALMF) و تیم Peppercock در EMBL Heidelberg، گروه Isidro Cortés-Cirino در EMBL-EBI، و تیم Andreas Kolozic در مرکز تحقیقات سرطان آلمان (DKFZ)، که بخشی از واحد مشارکت پزشکی مولکولی (MMPU) با دانشگاه Heidelberg است.
MAGIC بسیار انعطاف پذیر و سازگار است. در این مطالعه، الگوریتم برای شناسایی ریزهسته ها آموزش داده شد، اما در اصل می توان آن را بر روی هر ویژگی سلولی قابل مشاهده آموزش داد. کوربل می گوید: «تا زمانی که یک ویژگی وجود داشته باشد که بتوان آن را از یک سلول معمولی متمایز کرد، هوش مصنوعی می تواند آن را یاد بگیرد. بنابراین، سیستم ما می تواند به پیشرفت اکتشافات آینده در زمینه های مختلف زیست شناسی کمک کند.”